PRINCIPE
La microscopie de fluorescence permet la visualisation d’éléments ou molécules cellulaires à l’aide de fluorochromes ou de protéines fluorescentes (famille des GFP).
Après excitation par une source de lumière (lampe à vapeur de mercure, LED) ces molécules émettent une lumière, la fluoresence, caractérisée par sa longueur d’onde d’émission.
L’acquisition d’images est réalisée sur des échantillons très fins (monocouches cellulaires, micro-coupes, (soit environ 10µm), etc. afin d’observer la transmission de la lumière visible et d’obtenir un meilleur contraste entre la diffusion de la source de lumière par l’échantillon et la fixation des marqueurs fluorescents à l’intérieur ou à la surface de l’échantillon.
La station de vidéo microscopie CARLZEISS AXIO OBSERVER Z1 qui se compose de plusieurs éléments :
→ une source COLIBRI permettant l’analyse de fluorescences (4 LED d’excitation de 365nm, 470nm, 530nm et 625nm) associée à 5 cubes filtres
→ un système ApoTome 1 servant à la réalisation d’images d’une définition proche de la confocalité,
→ une chambre d’incubation thermostatée à atmosphère contrôlée,
→ une caméra numérique OrcaR2.

Le microscope inversé est équipé d’objectifs 5x, 10x, 20x, 20xLD, 40xLD à sec et d’un objectif 40x à immersion à huile.
La source Colibri dispose de 4 LED d’excitation (365nm, 470nm, 530nm et 625nm) qui permettent l’utilisation d’un grand nombre de molécules fluorescentes, grâce à cette gamme de d’excitation large. Le système dispose de 5 cubes filtres permettant ainsi de balayer la gamme de longueur d’onde de la majorité des molécules fluorescentes appliquées à la microscopie de fluorescence de l’UV au rouge lointain, le tout associé au contraste de phase visible en DIC (Contraste Interférentiel Différentiel).
Le système motorisé permet de réaliser des expériences multiparamétriques dans des conditions de température, d’atmosphère CO2 et O2, d’humidité contrôlées et ceci au court du temps.
Le système ApoTome 1 permet de réaliser ces images de fluorescences avec une définition proche de la confocalité pour des échantillons préparés sur verre.
La station de vidéo microscopie CARL ZEISS AXIO OBSERVER Z7 qui se compose de plusieurs éléments :
→ une source COLIBRI permettant l’analyse de fluorescences (7 LED d’excitation de 385nm, 430nm, 475nm, 511nm, 555nm, 590nm et 630nm) associée à 5 cubes filtres
→ un système ApoTome 2 servant à la réalisation d’images d’une définition proche de la confocalité,
→ une chambre d’incubation thermostatée à atmosphère contrôlée,
→ une caméra numérique OrcaFlash4.

Le microscope inversé est équipé d’objectifs 5x, 10x, 20x, 20xLD, 40x à sec et d’un objectif 63x à immersion à huile.
La source Colibri dispose de 7 LED d’excitation (385nm, 430nm, 475nm, 511nm, 555nm, 590nm et 630nm) qui permettent l’utilisation d’un grand nombre de molécules fluorescentes, grâce à cette gamme de d’excitation large. Le système dispose de 5 cubes filtres permettant ainsi de balayer la gamme de longueur d’onde de la majorité des molécules fluorescentes appliquées à la microscopie de fluorescence de l’UV au rouge lointain, le tout associé au contraste de phase visible en DIC (Contraste Interférentiel Différentiel).
Le système motorisé permet de réaliser des expériences multiparamétriques dans des conditions de température, d’atmosphère CO2, d’humidité contrôlées et ceci au court du temps.
Le système ApoTome 2 permet de réaliser ces images de fluorescences avec une définition proche de la confocalité pour des échantillons préparés sur verre.
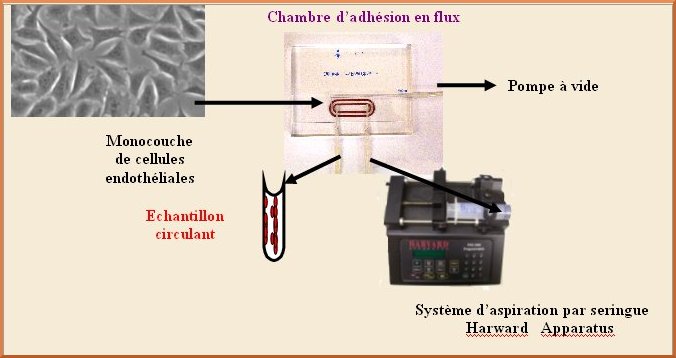
Cette station permet de visualiser différents phénomènes cellulaires dynamiques impliquant des cellules circulantes ou des molécules dans des conditions simulant le flux sanguin. Ces expériences sont réalisées à l’aide d’une chambre d’adhésion en flux.
EXEMPLES D’EXPÉRIENCES