Edison ZHAMUNGUI, doctorant dans l'équipe "Spectrométrie de masse fonctionnelle des assemblages moléculaires", soutiendra sa thèse le mercredi 5 juillet 2023 à 10h30 à l'Auditorium Charles Sadron, Campus CNRS d'Orléans.
Télécharger l'avis de soutenance de thèse
Résumé :
Bien que les protéines membranaires représentent 2/3 des cibles thérapeutiques potentielles, 10% seulement on fait l'objet de développement de médicaments les visant. Ceci s'explique par un manque de données sur les caractéristiques structurales qui sous-tendent leur fonction, dû aux défis que représentent leur production et le besoin d'agents de solubilisation. Des fonctions biologiques majeures reposent sur l'interaction de protéines-clé avec d'autres biomolécules telles que des acides nucléiques, des peptides, ou d'autres protéines, avec lesquelles elles forment de larges complexes. C'est précisément la taille de ces complexes (c à d. 100 000 Da et plus) ainsi que leur hétérogénéité qui imposent des limites à leurs caractérisations structurales.
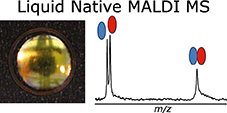
Au cours des dix dernières années, la caractérisation de complexes non-covalents par spectrométrie de masse native ou nMS s'est révélée être un allié de valeur des techniques de Biologie Structurale telles que la cristallographie aux rayons X, la RMN, ou la cryo-EM. Dans ce travail de thèse, nous montrons qu'une nouvelle méthode de spectrométrie de masse appelée Native Liquid MALDI (NALIM) fournit des informations sur la structure et l''tat fonctionnel de complexes de protéines membranaires et de complexes solubles.
NALIM-TOF MS s'appuie sur les points forts reconnus de la technique MALDI-TOF MS, tels qu'une bonne tolérance aux contaminants, une faible consommation d'échantillon, et une gamme de masse en principe illimitée. Avec des conditions d'analyse contrôlées pour être non-dénaturantes, et une optimisation spécifique des paramètres instrumentaux, la technique NALIM permet un accès rapide pour caractériser des protéines membranaires de type transporteur, y compris un transporteur ABC et un canal ionique. La stabilisation du dimère de la protéine Bacillus subtilis multidrug resistance (BmrA) par interaction avec un ligand a pu être démontrée, et le site de liaison de l'actitoxine Tx7335 actitoxin sur le canal potassique KcsA s'est avéré distinct de celui des toxines bloquant le pore. Afin de se rapprocher des conditions in vivo de la bicouche lipidique de la membrane native, le NALIM a été appliqué à la caractérisation de protéines membranaires en proteoliposomes et en nano-vésicules membranaires.
Le développement de la méthode NALIM a nécessité l'exploration de différentes protéines pour identifier un calibrant adapté à la gamme de masse élevé. Une préparation d'alpha1-antitrypsine (α1AT) qui forme une échelle moléculaire étendue sur une large gamme de masse a pu être validée comme étalon. De plus, un ajustement spécifique des paramètres instrumentaux a conduit à optimisation de la résolution et de la sensibilité jusqu`à 500 000 Da. Grâce à cela, il est possible de mesurer la stœchiométrie et la stabilité de grands complexes solubles. Par exemple, la stœchiométrie et la spécificité d'une distribution d'oligomères de la protéine ZBTB8A ont pu être déterminées par NALIM, et l'effet stabilisant de NusG sur l'hexamère de Rho mis en évidence.
En résumé, la méthode NALIM permet une caractérisation structurale rapide et de complexes de protéines membranaires et de grands oligomères solubles dans leur état natif. L'information obtenue par NALIM peut être un apport significatif dans les domaines de la biologie moléculaire et de la pharmacologie. Enfin, la méthode NALIM promet d'être une alternative intéressante comme nouvelle stratégie de découverte de nouveaux médicaments.
Mots-clés :
Spectrometrie de masse native, nMS, NALIM, MALDI-TOF, biologie structurale, protéine membranaire, oligomères, grands complexes, échelle moléculaire, interactions protéine-protéine, stoichiometrie, ligand, binding.