La spectrophotométrie est une méthode analytique quantitative qui consiste à mesurer l’absorbance (ou densité optique) d’une substance chimique en solution limpide, en utilisant une lumière sensiblement monochromatique. On peut ainsi, par exemple, déterminer la concentration d’une substance en mesurant l’absorption relative de la lumière par rapport à celle d’une substance de concentration connue. Cette méthode d’analyse est intéressante car elle permet de travailler sur de faibles quantités de substance, de manière non destructrice vis-à-vis de l’échantillon. Elle s’applique à un très grand nombre de dosages. On peut aussi l’utiliser pour déterminer la concentration précise d’un composé absorbant à partir de son coefficient d’extinction molaire, notamment pour les acides nucléiques et les protéines.
Lorsqu’une lumière d’intensité I0 passe à travers une solution, une partie de celle ci est absorbée par le(s) soluté(s). L’intensité I de la lumière transmise est donc inférieure à I0. On définit l’absorbance A de la solution comme :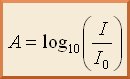 L’absorbance est une valeur positive, sans unité. Elle est d’autant plus grande que l’intensité transmise est faible.
L’absorbance est une valeur positive, sans unité. Elle est d’autant plus grande que l’intensité transmise est faible.
La relation de Beer-Lambert décrit que, à une longueur d’onde λ donnée, l’absorbance d’une solution est proportionnelle à la concentration des espèces de la solution et à la longueur du trajet optique (distance sur laquelle la lumière traverse la solution). Ainsi, pour une solution contenant une seule espèce absorbante :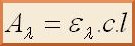
Aλ est l’absorbance de la solution pour une longueur d’onde λ ελ (en mol-1.L.cm-1) est le coefficient d’extinction molaire de l’espèce absorbante en solution à cette longueur d’onde λ c (en mol.L-1) est la concentration de l’espèce absorbante l (en cm) est la longueur du trajet optique
La loi de Beer-Lambert est additive. Ainsi, pour une solution contenant plusieurs espèces absorbantes, l’absorbance de la solution est la somme de leurs absorbances.