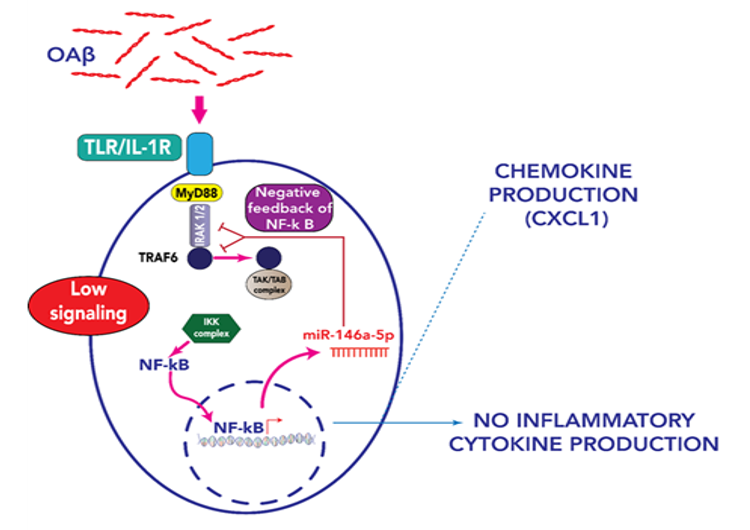
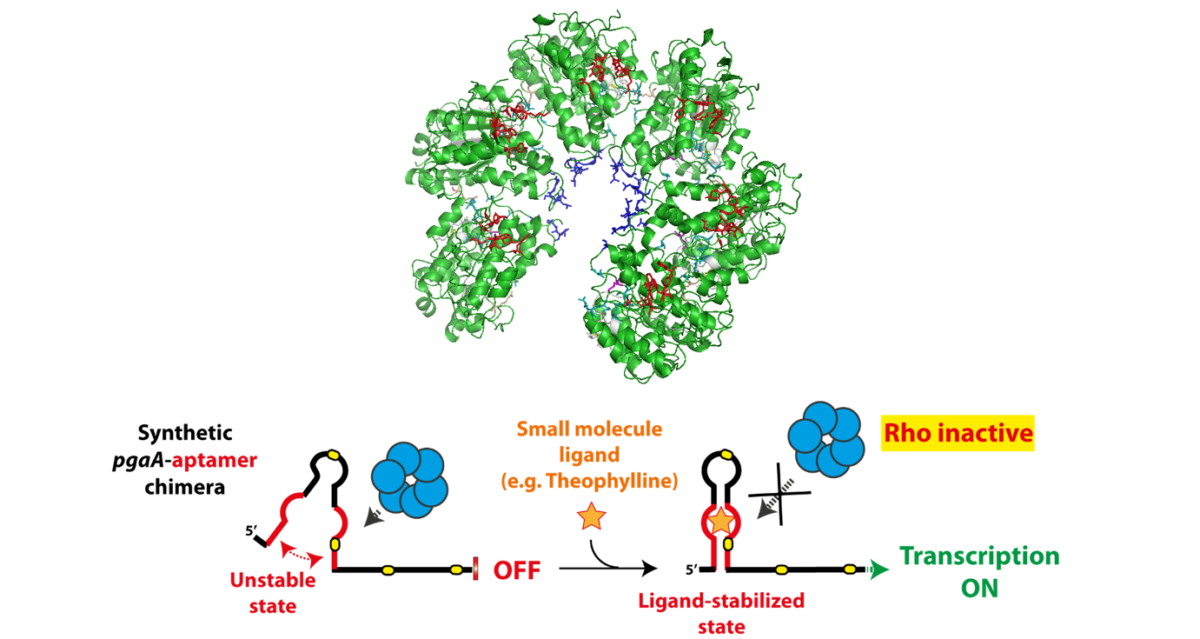
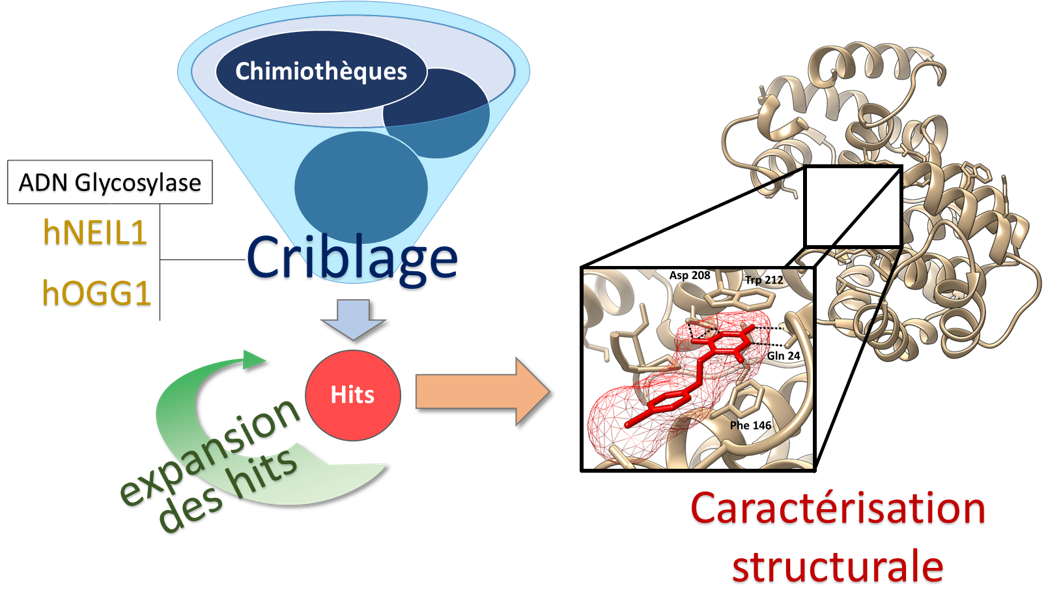
Ruth Elizabeth AQUINO ORDINOLA, doctorante du groupe thématique "Thérapies innovantes et nanomédecine", soutiendra sa thèse intitulée "Analyse de l'expression des microARNs circulants dans un modèle animal de la maladie d'Alzheimer"
Mercredi 22 décembre 2021 à 16 h à la salle de conférence du CBM.
La soutenance sera retransmise en visioconférence. Demander les codes de connexion à cbmsec@cnrs-orleans.fr