Le groupe « Signalisation cellulaire » dirigée par le Dr H. Bénédetti vient de publier dans JOVE, Journal of Visualized Experiments, journal à comité de lecture où les articles sont sous forme de video.
Cet article fait partie de la rubrique des méthodes et fondamentaux en biochimie.
Il détaille les techniques suivantes :
- transfections transitoires de plasmides dans des cellules eucaryotes
- extractions protéiques
- validation d’un anticorps
- étude d’interactions par co-immunoprecipitation
- étude de l’activité kinase d’une protéine par marquage au g32P-[ATP] ou en utilisant des anticorps phosphospécifiques
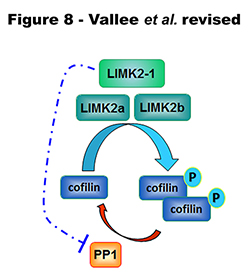
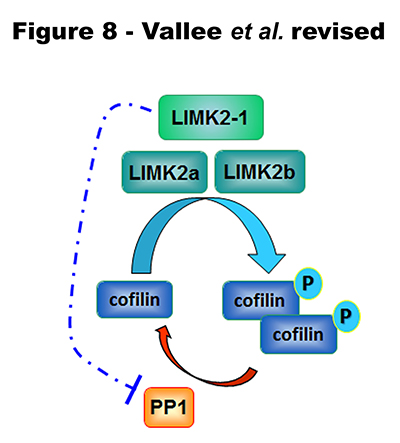
Ces techniques sont étoffées par les résultats qui ont été obtenus sur la protéine LIMK2-1, que l’équipe vient de mettre à jour et de caractériser. Cette protéine jusque là inconnue, existe bien, et est très atypique dans sa façon de réguler le remaniement du cytosquelette d’actine.