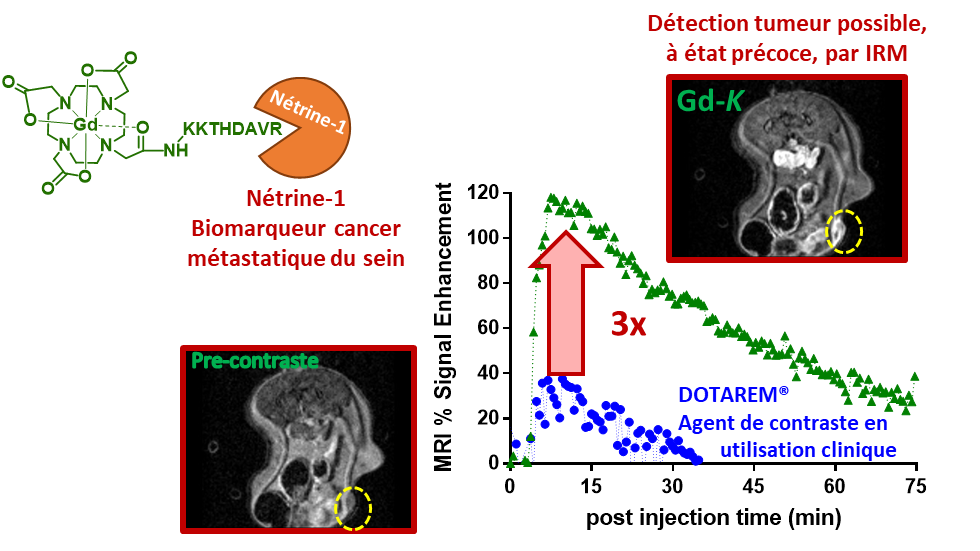
Malgré des progrès considérables ces dernières années en imagerie et traitement du cancer, des méthodes de diagnostic précoce de détection des métastases et une meilleure compréhension de la progression du cancer demeurent un réel besoin clinique. L'imagerie moléculaire peut répondre à ce besoin grâce à des agents de contraste ciblant des biomarqueurs tumoraux spécifiques. La Nétrine-1 est une protéine extracellulaire, impliquée dans la progression et l'agressivité tumorale, l'angiogenèse et l'apparition de métastases. Elle est surexprimée dans le cancer métastatique du sein.
Les chercheurs de l'équipe "Complexes métalliques et IRM" ont récemment conçu, synthétisé et validé in vivo la première sonde peptidique multimodale spécifique de la Nétrine-1. Une validation structurelle a été réalisée par modélisation moléculaire grâce à une collaboration entre le CBM et l’Institut de Chimie Organique et Analytique.
Cette sonde a permis aux chercheurs de visualiser très clairement, par imagerie de résonance magnétique (IRM), des tumeurs triple négatif du sein à un stade précoce du développement (tumeurs de volume 0-50 mm3). Ce type de sonde permet également l’imagerie par tomographie d'émission monophotonique.
Cette approche bimodale balaye une large gamme de concentrations de cible (nM à μM) et permet la cartographie de la Netrin-1, in vivo dans des modèles murins de cancer, à différents stades d'évolution tumorale.
Référence :
Clémentine Moreau, Tea Lukačević, Agnès Pallier, Julien Sobilo, Samia Aci-Sèche, Norbert Garnier, Sandra Même, Éva Tóth and Sara Lacerda
Peptide-Conjugated MRI Probe Targeted to Netrin-1, a Novel Metastatic Breast Cancer Biomarker
Bioconjugate Chem. https://doi.org/10.1021/acs.bioconjchem.3c00558