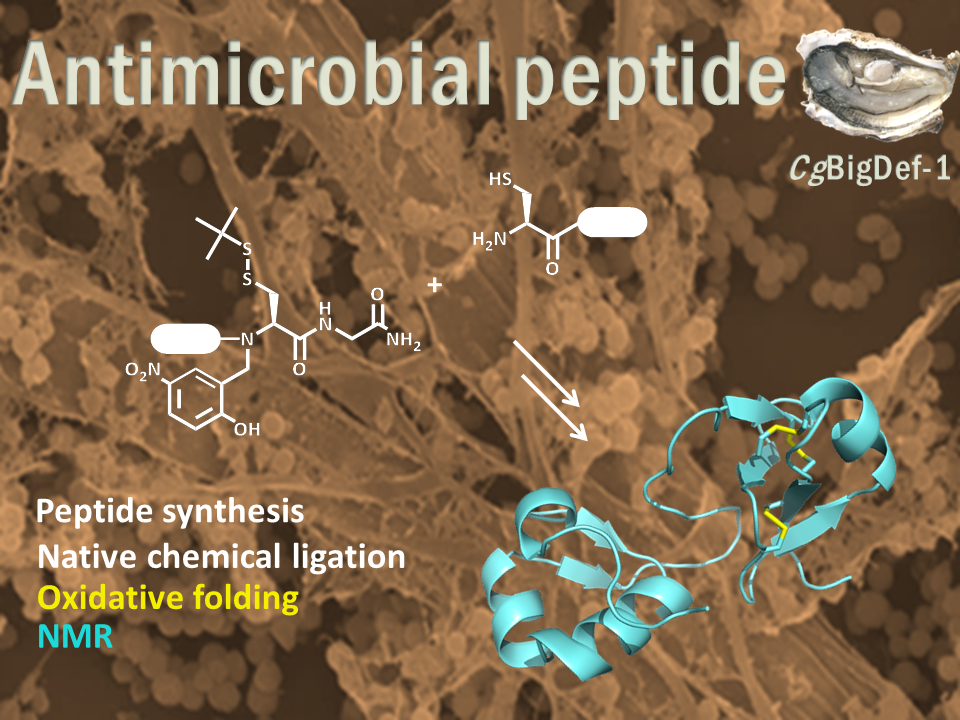
Les big défensines, ancêtres des β-défensines, sont composées d'un domaine de type β-défensine et d'un domaine ancestral hydrophobe. Cette structure unique se retrouve dans un nombre limité d'espèces marines phylogénétiquement éloignées.
En utilisant la chimie des peptides en phase solide et la ligation chimique native, nous avons produit la BigDef1 de l’huitre Crassostrea gigas (Cg-BigDef1) et ses domaines séparés et caractérisé leur structure 3D par RMN. Cg-BigDef1 a montré une activité bactéricide à large spectre y compris contre les isolats cliniques multirésistants de S. aureus. Le domaine ancestral N-terminal confère au domaine de type β-défensine, inactif seul, une activité antimicrobienne qui n’est pas perturbée par un milieu salé. De plus, au contact des bactéries, le domaine hydrophobe entraîne l'assemblage de Cg-BigDef1 sous forme de nanofibres qui enserrent et tuent les bactéries. Nous supposons que le domaine N-terminal hydrophobe des big défensines a été maintenu dans les phyla marins pour renforcer les interactions des défensines avec les membranes bactériennes dans les environnements marins salés où les interactions électrostatiques sont altérées.
Ces propriétés remarquables ouvrent la voie à de futurs développements de candidats-médicaments pour remédier à l’inhibition de l'activité antimicrobienne des β-défensines de vertébrés en concentration saline physiologique (ANR MOSAR-Def 2019-2023).
Un grand merci à D. Destoumieux-Garzón pour sa collaboration, à « Vaincre La Mucovidose » et "CNRS PEPS X-life" pour le financement.