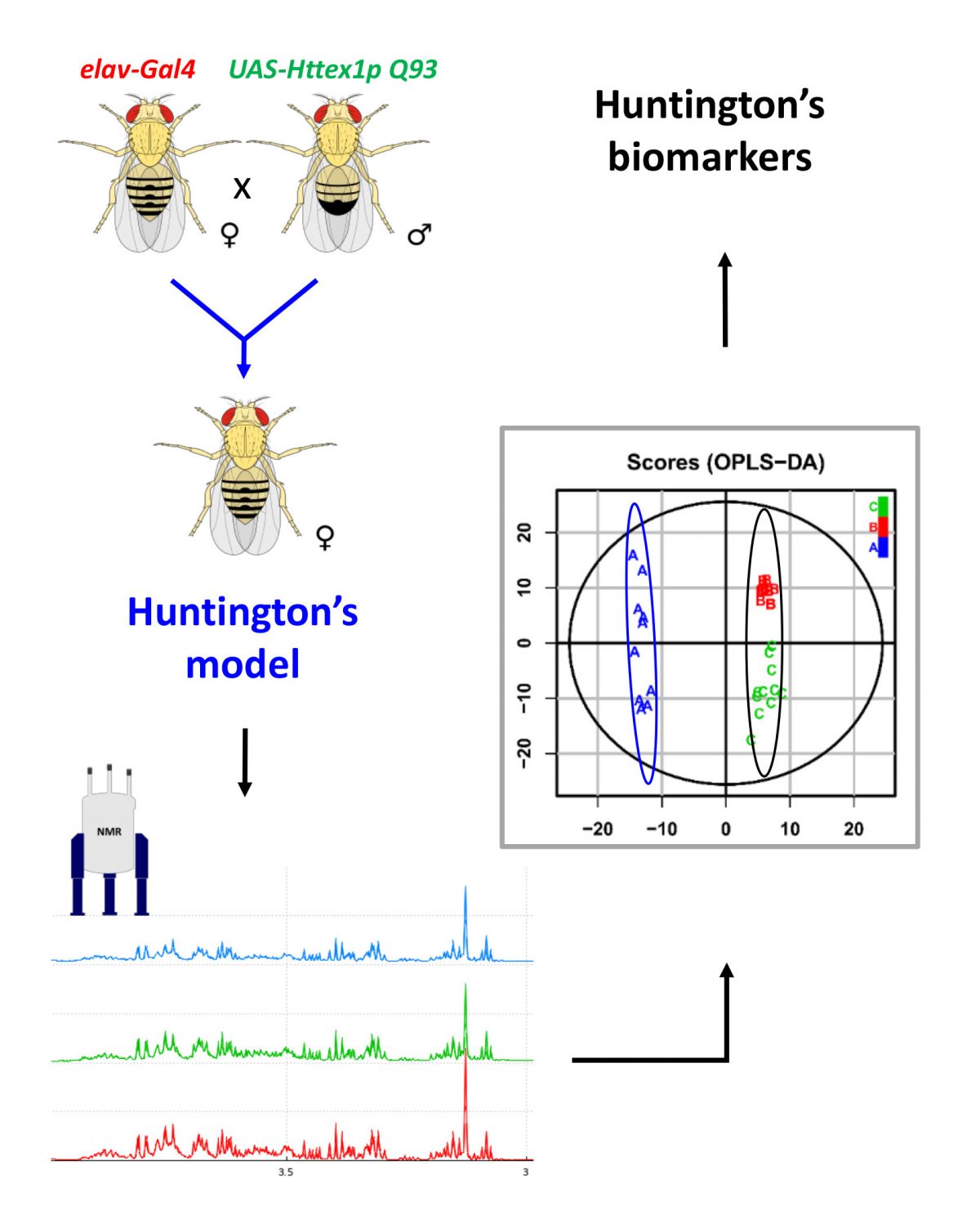
La maladie de Huntington (HD) est une maladie neurodégénérative héréditaire, pour laquelle il est urgent de développer un diagnostic et de découvrir de nouvelles cibles thérapeutiques. Dans cette étude, un modèle de HD chez Drosophila melanogaster a été utilisé pour identifier des biomarqueurs métaboliques aux stades présymptomatiques et symptomatiques de la maladie. L'expression pan-neuronale d'un fragment pathogène de la protéine Huntingtin (HTT) humaine contenant une expansion de 93 glutamines chez la drosophile induit une neuropathologie présentant plusieurs caractéristiques de la maladie humaine. Les métabolites discriminants entre les mouches malades et leurs témoins ont été identifiés par RMN 1D et par analyse multivariée OPLS-DA.
Les chercheurs du groupe "RMN des biomolécules" ont ainsi identifié un ensemble de 10 biomarqueurs du stade présymptomatique : NAD+, AMP, fumarate, asparagine, diméthylamine, β-alanine, glutamine, succinate, glutamate et éthanol. Fait remarquable, les expériences menées au stade symptomatique, ont mis en évidence un ensemble différent de 6 biomarqueurs : phosphocholine, éthanolamine, 2-oxoglutarate, succinate, pyruvate et acétate. Les résultats permettent de mieux comprendre les déficiences métaboliques dans un modèle de HD largement utilisé et démontrent que les perturbations du métabolisme changent radicalement au cours du développement de la maladie.
Metabolomic Nuclear Magnetic Resonance Studies at Presymptomatic and Symptomatic Stages of Huntington’s Disease on a Drosophila Model
Marylène Bertrand, Martine Decoville, Hervé Meudal, Serge Birman, and Céline Landon
Journal of Proteome Research (2020) 19, (10) 4034-4045 - doi : 10.1021/10.1021/acs.jproteome.0c00335