Catégorie d'actualités : Publications marquantes
Des chercheurs du CBM ont mis au point des cellules-outils novatrices pour rechercher à haut débit de nouvelles molécules antibactériennes plus efficaces et plus spécifiques
Comment solubiliser des principes actifs hydrophobes ?
Un article du professeur Gerald Kneller a été sélectionné pour figurer dans le « 2016 JCP Editors’ Choice »
Découverte de fossiles de micro-organismes de 4 milliards d’années au Canada
Neurofibromatose : comment la protéine Nf1 impacte les processus de mémorisation
Une technique innovante de production de minicercles d’ADN ouvre la voie au développement d’une nouvelle classe d’oligonucléotides leurre moléculaire à visée thérapeutique
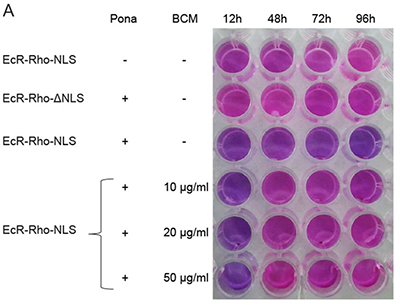
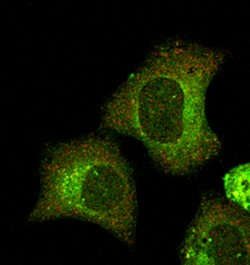
Des oligonucléotides ADN en double brin et linéaires dit à activité leurre moléculaire constituent une classe de petits acides nucléiques à visée thérapeutique. Ils sont capables de se lier spécifiquement à une cible protéique avec une affinité forte, de la séquestrer et en conséquence d’invalider sa fonction. Cette stratégie est utilisée pour inhiber chirurgicalement la transcription de gènes impliqués dans plusieurs pathologies humaines (maladies inflammatoires et cardiovasculaires, cancer) en inhibant différents facteurs de transcription cible comme NF-ĸB. Plusieurs essais cliniques ont conclu à un manque d’efficacité en partie due à une faible biostabilité de l’oligonucléotide leurre qui est digéré par des exonucléases sériques et cellulaires à partir de ses extrémités libres. La recherche s’est alors orientée vers une fonctionnalisation chimique des oligonucléotides linéaires pour offrir une meilleure biostabilité mais au détriment d’une activité de piégeage moins grande. Notre approche consiste à circulariser l’oligonucléotide leurre pour le rendre résistant aux exonucléases sans aucune modification chimique. Cependant la rigidité intrinsèque de la double hélice d’ADN restait une barrière pour produire des quantités suffisantes d’oligonucléotides circulaires (minicercle) de moins de 250 paires de base et permettre de tester leur activité biologique. Grâce à une approche d’ingénierie d’acides nucléiques se situant à l’interface de la physico-chimie, de la nanotechnologie de l’ADN, de la vectorologie chimique des acides nucléiques et de la biologie cellulaire, nous avons mis au point une nouvelle technique de production quantitative et versatile de minicercles d’ADN et fait la preuve de concept in cellulo d’une activité leurre moléculaire d’un minicercle dirigé contre NF-ĸB. Ce travail ouvre maintenant la voie au développement d’une nouvelle classe d’oligonucléotides circulaires d’ADN à activité leurre moléculaire.
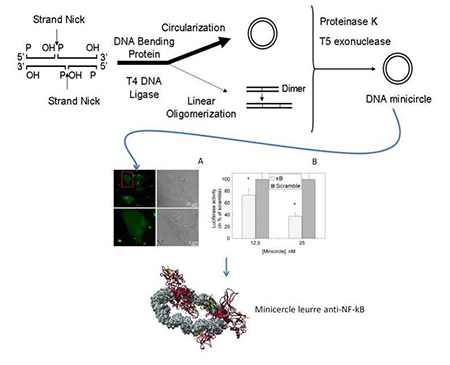 Production of DNA minicircles less than 250 base pairs through a novel concentrated DNA circularization assay enabling minicircle design with NF-ĸB inhibition activity.
Production of DNA minicircles less than 250 base pairs through a novel concentrated DNA circularization assay enabling minicircle design with NF-ĸB inhibition activity.
Thomas Thibault, Jeril Degrouard, Patrick Baril, Chantal Pichon, Patrick Midoux and Jean-Marc Malinge
Nucleic Acids Research – accepted 21 octobre 2016 – doi: 10.1093/nar/gkw1034