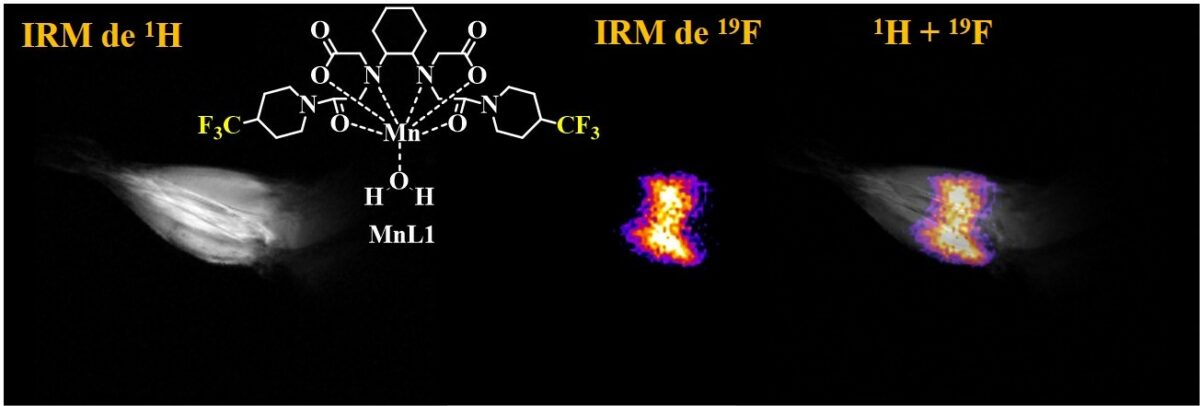
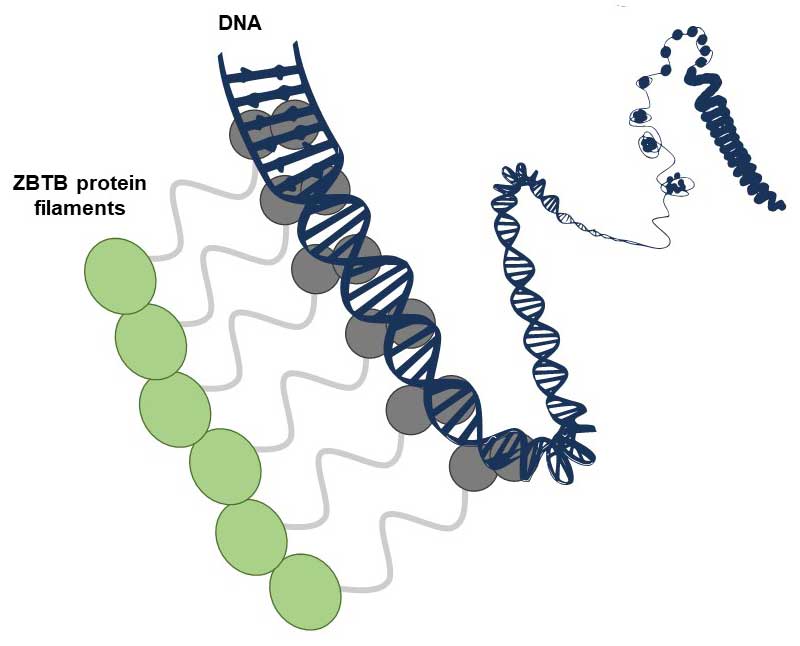
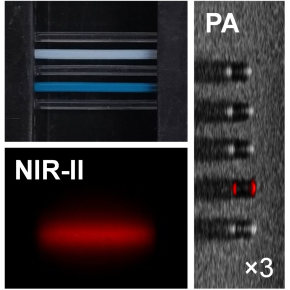
Le choc froid est un stress courant pour les bactéries pathogènes vivant dans des hôtes à sang chaud. Il se produit lors de leur libération brutale, de l'hôte vers l’environnement comparativement plus froid. Il est essentiel de comprendre comment les agents pathogènes font face au choc froid pour déterminer comment ils survivent sur des surfaces contaminées et se propagent à de nouveaux hôtes.
L'équipe "Remodelage de l'ARN" et des chercheurs de l'I2BC ont découvert que le facteur de terminaison de la transcription Rho est un acteur crucial de la réponse bactérienne au choc froid, remettant ainsi en cause l'idée répandue selon laquelle cette réponse est essentiellement posttranscriptionnelle. Des structures ARN sensibles à la température permettent (à 37°C) ou empêchent (à 15°C) la terminaison Rho-dépendante de la transcription, et donc l’expression, de gènes de réponse au choc froid. Pendant l'acclimatation au froid, les protéines de réponse au choc froid s'accumulent jusqu'à atteindre une concentration suffisante pour se lier aux structures ARN thermosensibles et les rendre de nouveau susceptibles à l'action de Rho, fournissant ainsi un contrôle par rétroaction négative de leur propre expression. Cette boucle de régulation s'ajoute aux mécanismes post-tanscriptionnels déjà connus pour assurer une régulation étroite et rapide de l’expression des gènes de réponse au choc froid.
Cette découverte, publiée dans la revue Molecular Cell, illustre la complexité des réponses bactériennes au stress et le potentiel de Rho comme cible thérapeutique. Elle a été signalée par CNRS Chimie et CNRS Biologie sur leurs sites internet.
Référence :
Rho-dependent transcriptional switches regulate the bacterial response to cold shock
Mildred Delaleau, Nara Figueroa-Bossi, Thuy Duong Do, Patricia Kerboriou, Eric Eveno, Lionello Bossi, & Marc Boudvillain*
Molecular Cell https://doi.org/10.1016/jmolcel.2024.07.034