Doctorants de 1ère année, de haut en bas et de gauche à droite :
Gilles Metrard, Johnathan Black, Océane Quin, Gilles Le Rouzic, Simon Héry, Audrey Roussel, Daniela Teixeira, Abdoul Kaboré, Ayena Kossi, Aanchal Mishra, Steevens Bouaziz , Petra Cutuk.
Sujets des thèses :
Département "Aspects Moléculaires du Vivant" :
Johnathan Black "Discovery of new riboswitches by very large-scale enzymatic screening"
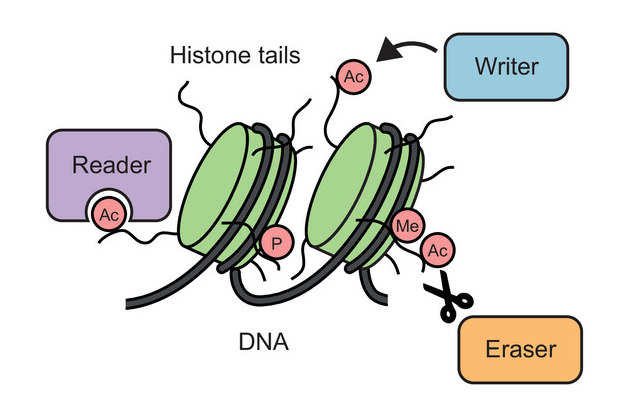
Aanchal Mishra "Mechanisms of protein SUMOylation: understanding through the lenses of SUMO-SIM enigma"
Emma Leborgne "Study of sequence-activity relationships and the structure of alterocin and antibiofilms secreted by a marine bacterium"
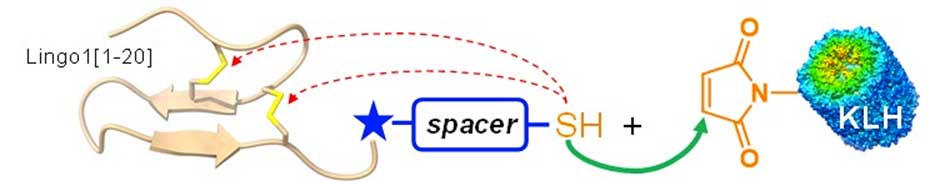
Audrey Roussel "Towards a new anti-cancer therapy targeting microtubules"
Département "Biologie et Biophysique des récepteurs, Applications translationnelles (BioBRAT)"
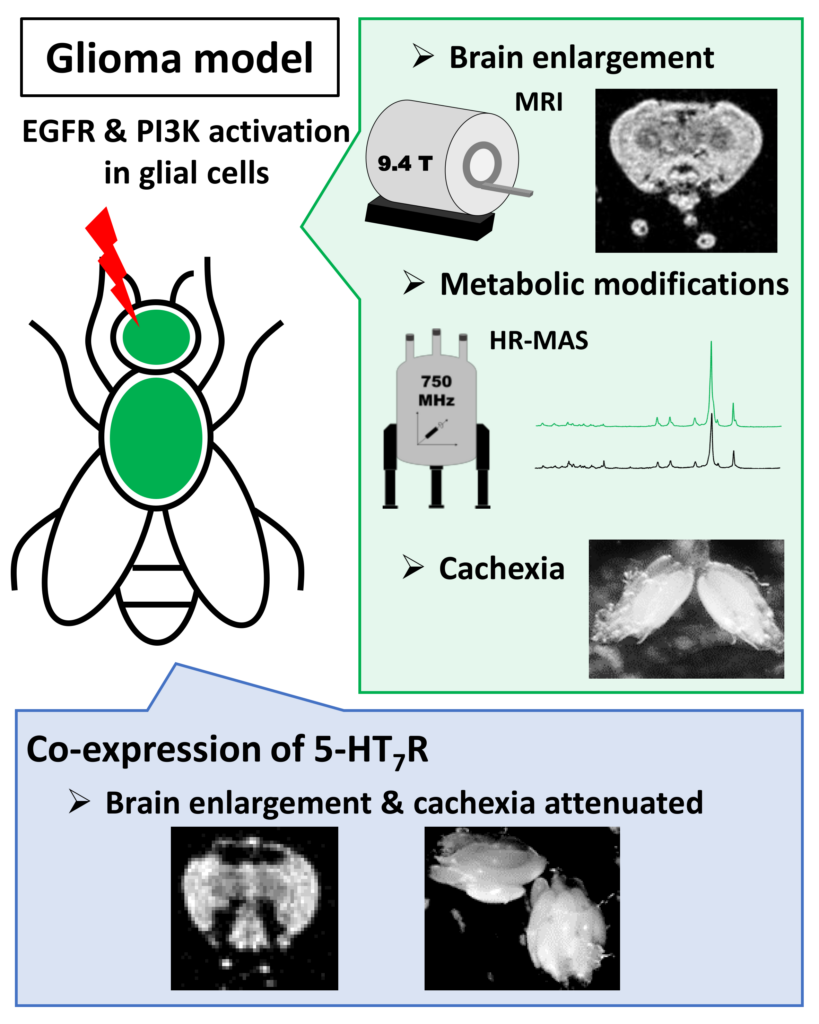
Abdoul Kaboré "Functionnal details of biased signaling elicited by serotonin 5HT7 receptor"
Ayena Kossi "Therapeutic properties of cannabinoids and development of their pharmacological applications"
Océane Quin "Development o f cellular and molecular tools for the study of the mechanisms of action of phytocannabinoids in the skin"
Département "Chimie Imagerie et Exobiologie"
Petra Cutuk "Regulation of SKCa channels by cAMP/PKA pathway in cancer cells: development of novel near-infrared optical imaging tools"
Léa Diebold "Towards tumour theranostics: hypoxia activation as a tool for therapy and diagnostics"
Simon Héry "Novel metal-based agents for selective amyloid imaging"
Gilles Le Rouzic "Quantitation in SPECT cardiology 3D CZT camera contribution"
Gilles Metrard "4D dynamic images in SPECT/CT"
Daniela Teixeira "Manganese(III) porphyrin and hemiporphyrazine complexes: towards safer, more selective and efficient MRI contrast agents"
Département "NanoMatériaux et NanoSondes"
Steevens Bouaziz "Autologous production of biological drugs: AutomAb project"
Laura Divoux "Natural deep eutectic solvents - based formulations for skin care"