UV-Visible spectroscopy probes the electronic transitions of molecules that absorb light in the UV and visible regions of the electromagnetic spectrum.
This can be used to identify substances in a sample, to determinate concentration of proteins or nucleic acids, to study enzymatic assays, etc.
Two spectrophotometers are available at the facility, both standard research-grade UV/Vis double-beam spectrophotometer. The V670 system provides users with excellent performances: extended spectral range (190 - 2700nm), very low noise level (0.0005 OD), extended linearity (>4 OD in the visible, >3 OD in the NIR).
Lorsqu’une lumière d’intensité I0 passe à travers une solution, une partie de celle ci est absorbée par le(s) soluté(s). L’intensité I de la lumière transmise est donc inférieure à I0. On définit l’absorbance A de la solution comme :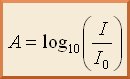 L’absorbance est une valeur positive, sans unité. Elle est d’autant plus grande que l’intensité transmise est faible.
L’absorbance est une valeur positive, sans unité. Elle est d’autant plus grande que l’intensité transmise est faible.
La relation de Beer-Lambert décrit que, à une longueur d’onde λ donnée, l’absorbance d’une solution est proportionnelle à la concentration des espèces de la solution et à la longueur du trajet optique (distance sur laquelle la lumière traverse la solution). Ainsi, pour une solution contenant une seule espèce absorbante :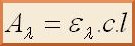
Aλ est l’absorbance de la solution pour une longueur d’onde λ ελ (en mol-1.L.cm-1) est le coefficient d’extinction molaire de l’espèce absorbante en solution à cette longueur d’onde λ c (en mol.L-1) est la concentration de l’espèce absorbante l (en cm) est la longueur du trajet optique
La loi de Beer-Lambert est additive. Ainsi, pour une solution contenant plusieurs espèces absorbantes, l’absorbance de la solution est la somme de leurs absorbances.